酸性やアルカリ性で色が変化するナスの色素(ナスニン)の抽出法とアルカリ性の安定性について〜自宅でできる簡単な研究(FR-3.5)
ナスの皮から抽出した溶液は、酸性やアルカリ性で色が変化する身近な食品として知られております(ナスを用いたpH指示薬の教材研究 )。ナスの皮の抽出液には、アントシアニン系色素のナスニンが含まれているからです。
以前、「ナスの色素(ナスニン)の酸性とアルカリ性による色の変化について」でナスの皮から抽出した溶液を使って、酸性やアルカリ性溶液による色の変化について実験した結果を紹介しました。その時は、抽出液がナスの紫色に褐色が含まれたものになり、精製など設備がないと綺麗な色の変化するナスニン抽出液を得ることは難しいという結論になりました。
今回、ナスニンの抽出方法を改良し、酸性とアルカリ性溶液による色の変化が見やすくなりましたので紹介します。また、ナスニンのアルカリ性溶液での色変化とホウ酸の影響について調べてみました。
何かの役には立たないし、人から見たらどうでも良いことで自己満足の世界でありますが、個人研究に取り組んでいます。
目次
1. ナスの皮からアントシアニン(ナスニン)を含む溶液の作製
2. 酸、アルカリ溶液による色の変化の実験
3. クエン酸-セスキ炭酸ナトリウムによるアルカリ性溶液
4. ナスニンの色変化におけるホウ酸の影響
1. ナスの皮からアントシアニン(ナスニン)を含む溶液の作製
ナスの皮からアントシアニン(ナスニン)を含む溶液を抽出する方法の一つを紹介します。
最初に、ナスをピーラーで皮を剥きます(下の写真左)。
後に水を加えた時に水と接する様に、下の写真右の様に外側の皮を下にします。

剥いた皮(約10g)をラップして電子レンジ500Wで1分加熱します(下の写真左)。
水約30mLを加え、ラップして電子レンジ500Wで1分加熱すると紫色のナスニンが含まれる溶液が得られます(下の写真右)。

このアントシアニン(ナスニン)が抽出された溶液をビーカーに入れます(下の写真(A))。
突沸しない様に電子レンジ500Wで1分ずつ数回ラップをせず加熱して濃縮します(下の写真(B)(C))。

以上でナスの皮からのアントシアニン(ナスニン)を含む溶液の作製は終了です。
2. 酸、アルカリ溶液による色の変化の実験
この方法で作製したナスニンを含む溶液を使って、酸性・アルカリ性溶液による色変化を調べてみました。
使用した酸性・アルカリ性溶液は、
1 : サンポール x20 (5%);一般情報によるpH
2 : 0.1M クエン酸;一般情報によるpH
3 : クエン酸-クエン酸ナトリウム (pH 3.0;pH試験紙によるpH
4 : Standard pH 4.00;下の写真左下
5 : クエン酸-クエン酸ナトリウム (pH 5.5);pH試験紙によるpH
6 : 0.1M ホウ酸水溶液;pH試験紙によるpH
7 : Standard pH 6.86;下の写真左下
8 : 0.1M 重曹-クエン酸 (pH 8.0);pH試験紙によるpH
9 : Standard pH 9.18;下の写真左下
10 : 0.1M セスキ炭酸ナトリウム;一般情報によるpH
11 : 0.2% アンモニア水;一般情報によるpH (pH:約11(20℃, 0.2%, 0.1M)実測値)
12 : 10% アンモニア水;一般情報によるpH (pH:12(20℃, 10%, 5.6M)参考値)
番号の 4, 7, 9 は、pH 4, 7, 9 標準液を使用しました。
番号の 1, 2, 10, 11, 12 は、一般的に言われている溶液のpHの値をそのまま使いました。
番号の 3, 5は、クエン酸バッファー調整法を参考に、pH試験紙を使用して調整しました。
番号の 8 は、pH試験紙を使用して確認しました。
です。
下の写真(A)はナスニンを含む溶液を(20倍希釈量)入れた直後で、(B)は10分後の色変化です。
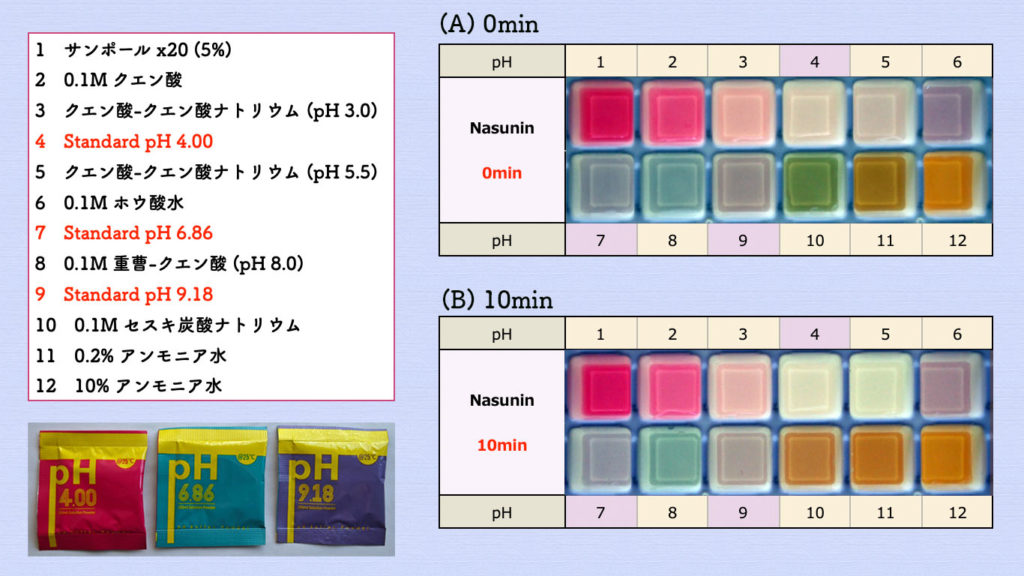
番号9のpH9.18 標準液で中性付近と同じ紫色になりました。また、(B)の反応10分後で番号10から12のアルカリ溶液で色が黄土色に変化していました。
3. クエン酸-セスキ炭酸ナトリウムによるアルカリ性溶液
番号9のpH9 は、中性付近と同じ紫色になり、pH8 の重曹溶液と pH10 のセスキ炭酸溶液との色の連続性が失われている様に感じます。これは、紫キャベツの実験でも見られました「紫キャベツと巨峰を使った酸性とアルカリ性による色の変化について」。
番号9は、標準液 pH9.18 でホウ酸を使った緩衝液の可能性が考えられます(使用した標準液の組成は明示していませんでした)。
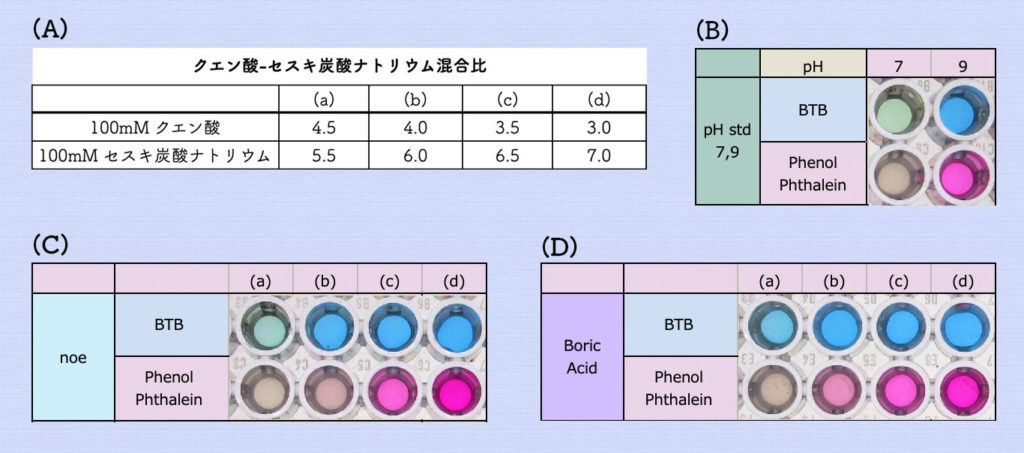
そこで、ホウ酸を含まないクエン酸とセスキ炭酸ナトリウムを使ってアルカリ性溶液(pH9)を作製しました。
下の写真(A)の混合比で(a)から(d)の溶液を作製しました。pHのチェックは、ブロモ・チモール・ブルー(BTB)溶液とフェノールフタレイン(PP)溶液を使用しました。
BTB溶液は、pH範囲が6.0(黄)~7.6(青)です。PP溶液は、pH範囲が7.8(無色)~10.0(紅色)です。
下の写真(B)は、pH6.86とpH9.18の標準溶液に対するBTB溶液とPP溶液の反応を示します。
これを基準に(a)から(d)のクエン酸-セスキ炭酸ナトリウム混合液のBTB溶液とPP溶液の反応を調べたのが下の写真(C)となります。(c)の混合液がpH9付近になる結果となりました。
下の写真(D)は、ホウ酸溶液によるナスニンの影響を調べる目的で、(a)から(d)のクエン酸-セスキ炭酸ナトリウム混合液に、中和したホウ酸溶液を最終濃度が10mMとなる様に加えたものです。(b)と(c)の間がpH9付近になる結果となりました。
4. ナスニンの色変化におけるホウ酸の影響
上記のpHを調べたアルカリ性溶液でのナスニンの色変化を調べてみました。下の写真(A)は反応直後、(B) 20分後、(C) 40分後のナスニンの色変化です。「none」はコントロールで水を加えた時で、「Boric Acid」は中和したホウ酸溶液を加えた結果です。
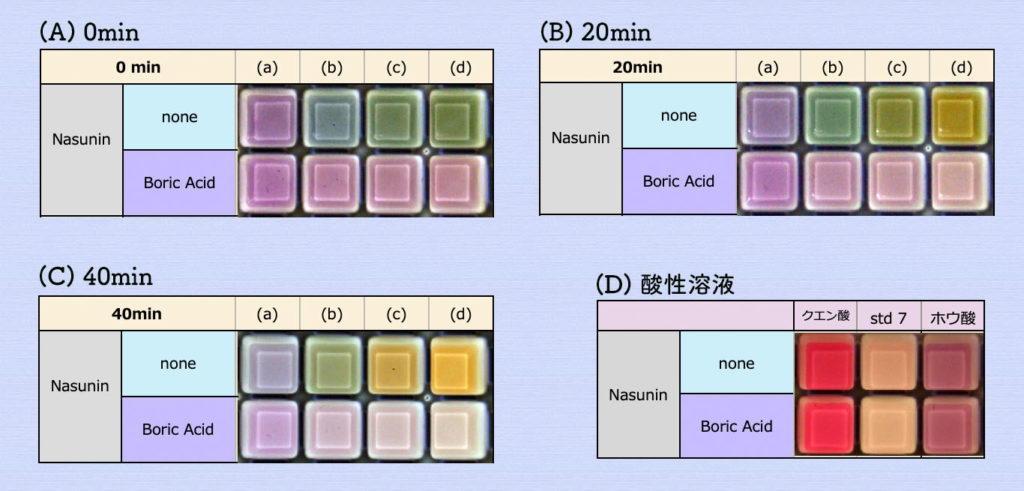
ホウ酸溶液を加えると、中性付近の色と同じ結果となりました。
標準液pH9.18で中性付近の色と同じになったのは、ホウ酸の影響によるものと考えられます。
酸性溶液では、ホウ酸の影響は見られませんでした(上の写真(D))。







ディスカッション
コメント一覧
まだ、コメントがありません