赤色105号とタンパク質の吸着についての検討〜自宅でできる簡単な研究(FR-2.2)
食紅の赤色105号(ローズベンガル)は、Bradford法の様にタンパク質の定量が可能であることを「食紅を使ったタンパク質の定量法(Bradford法の様に)」に掲載しました。
ここでは、ローズベンガルとタンパク質(ゼラチン)の吸着する反応について調べてみました。
試料の成分を呈色反応でデジタル画像から数値化する方法は、「デンプンやタンパク質を測定する実験の構想」「食紅をモデルにした呈色反応のデジタル画像取得法」「ImageJを用いた呈色反応モデル(食紅)のデジタル画像解析法」でほぼ確立しています。
考え方と目次
何かの役には立たないし、人から見たらどうでも良いことで自己満足の世界でありますが、デンプンやタンパク質を測定する実験の構想で述べた構想をもとに個人研究として取り組んでいます。
目次
1. 食紅とタンパク質の反応のおさらい
2. 反応の順番による発色の違い
3. ローズベンガルの退色するペーハー (pH) 値は?
4. 食紅とタンパク質の反応を透析で調べる
1. 食紅とタンパク質の反応のおさらい
タンパク質を呈色反応で定量化するBradford法をモデルとし、一般でも入手可能な食紅(赤色105号、ローズベンガル)で代用出来ることを「食紅を使ったタンパク質の定量法(Bradford法の様に)」で示しました。
内容は、
・ローズベンガルは、クエン酸によって赤色から透明に退色し、退色は可逆性(中和すると発色する)です。
・ローズベンガルは、ゼラチン(タンパク質)と吸着するとクエン酸による退色を免れますが、炭水化物(デンプン)ではこの現象は起こりません。
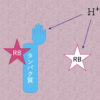
ローズベンガル、タンパク質と酸の関係は、下の図の左のイメージ図を考えています。
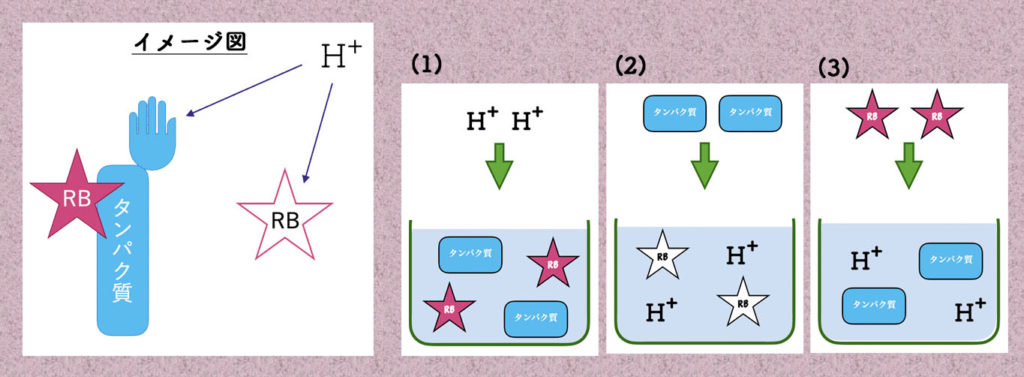
ローズベンガル(RB)は、タンパク質と吸着して酸(H+)からの攻撃を受けず赤色に発色したままですが、タンパク質と吸着していないローズベンガルは、酸の攻撃を受け発色せず透明になります。この現象から、タンパク質の量とローズベンガルの発色との相関関係が成立し、タンパク質量を計測することが可能となると考えています。
2. 反応の順番による発色の違い
さらに、詳しく上記の現象を調べてみました。
最初に、ローズベンガルとタンパク質の反応について、反応させる順番による発色の影響を調べてみました(上の図 1〜3)。
(1) ローズベンガルとゼラチン(タンパク質)を最初に反応させ、クエン酸で未反応のローズベンガルを退色させる。
(2) ローズベンガルとクエン酸を最初に反応させてローズベンガルを退色さた後、ゼラチンを加え反応させる。
(3) クエン酸とゼラチンを最初に加え、ローズベンガルを反応させる。
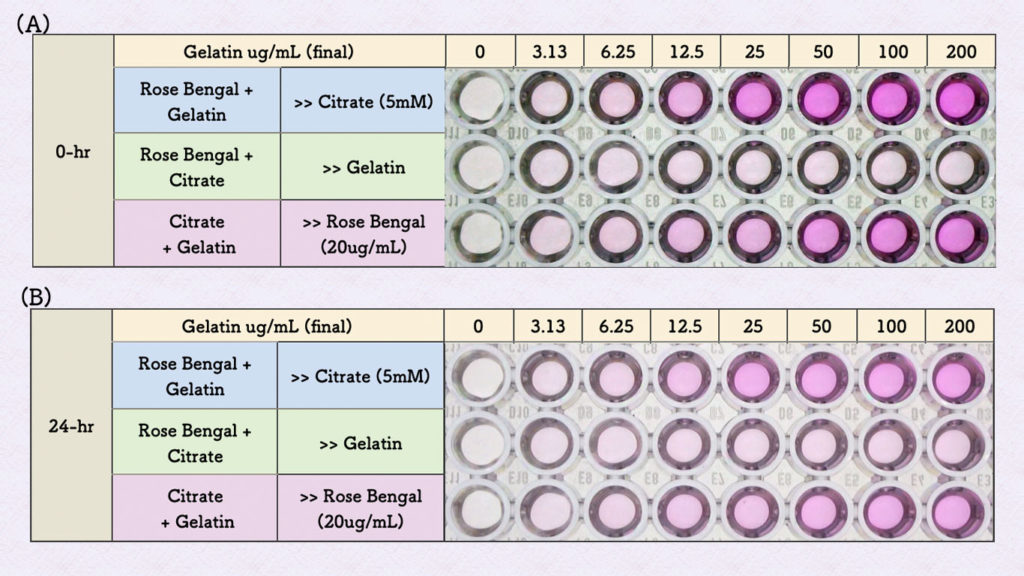
結果は上の図の様になりました。右のウェルがゼラチン濃度が濃く、左へ2倍の希釈系列で観察しています。
(2)のローズベンガルとクエン酸を反応させ後、ゼラチンを加えても発色しませんでした(上の図 A の2行目)。そのまま1日(24時間)放置し、翌日観察すると若干発色が認められましたが(1)と(3)の (上の図 B のそれぞれ1行目と3行目) 様な発色には戻りませんでした (上の図 B の2行目) 。
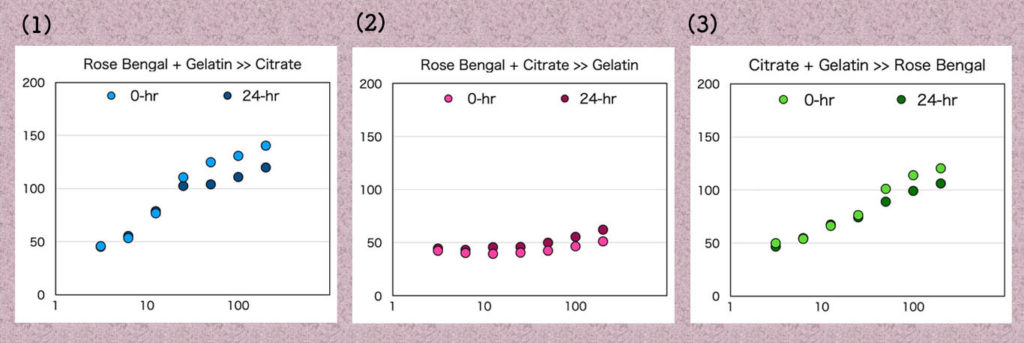
図のデーターを数値化し、G-チャンネルの吸光度を縦軸に、ゼラチンの濃度を横軸に(対数)してグラフにしました(上の図)。(1)から(3)で反応直後と24時間後でほとんど差は認められませんでした。
(2)は、ローズベンガルがクエン酸によって退色し変化することでゼラチンとの結合が出来ないか、ゼラチンと結合してももとの様に発色出来ないか、のどちらかだと考えています。
3. ローズベンガルの退色するペーハー (pH) 値は?
次に、ローズベンガルが退色するのは、どれくらいの酸性度かを調べてみました。ローズベンガルにクエン酸の2倍の希釈系列を反応させると、クエン酸濃度が0.63mMと1.25mMの間で色の変化が見られました。また、pH4.00の標準液を作製し(下の図 D、A : std4.0)ローズベンガルと反応させました(下の図 A)。
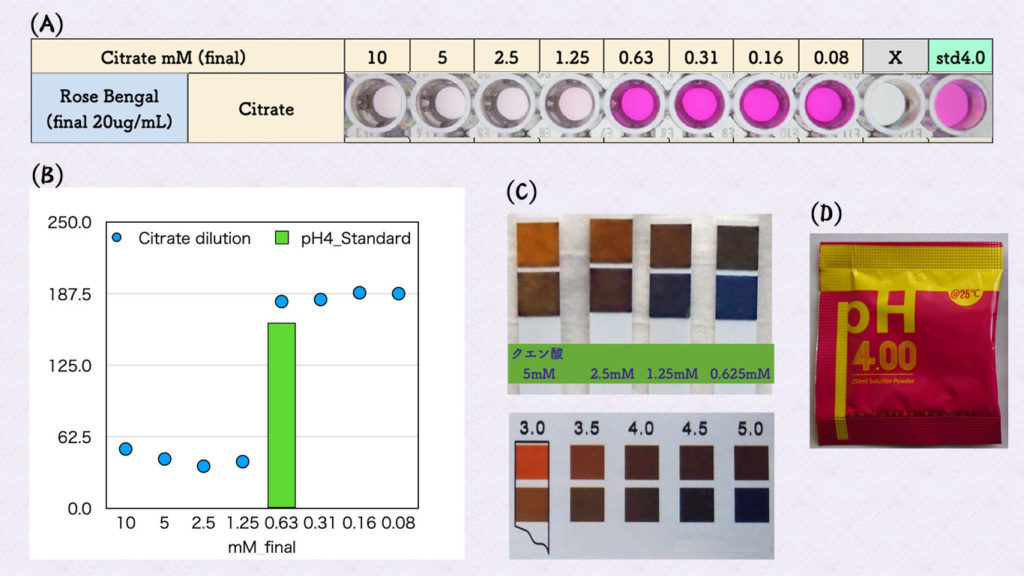
上の図の (B) は、横軸にクエン酸の2倍希釈系列、縦軸にG-チャンネルの吸光度を示しています。棒グラフがpH4.00の標準液を示しています。
この結果より、ローズベンガルは、pH4付近から退色が始まることがわかりました。pH4付近のpH指示薬として使えるかもしれません。上の図 (C) は、pH試験紙を使ってクエン酸の2倍希釈系列を調べています。
4. 食紅とタンパク質の反応を透析で調べる
最後に、ローズベンガルとゼラチンが吸着していることを確認するため、ゼラチンと未反応のローズベンガルを透析することで調べてみました。
透析膜は、「透析用セルローズチューブ(ヴィスキングチューブ) ケニス/S-5」で、分画分子量は約12,000~14,000(孔径50オングストローム) のものを使いました。ローズベンガルは、透析膜を通る事が出来ますが、ゼラチンは透析膜を通れません。
1.5mL遠心チューブの蓋に穴を開け、蓋を閉じることで透析チューブをはさむ方法で行いました(下の図)。

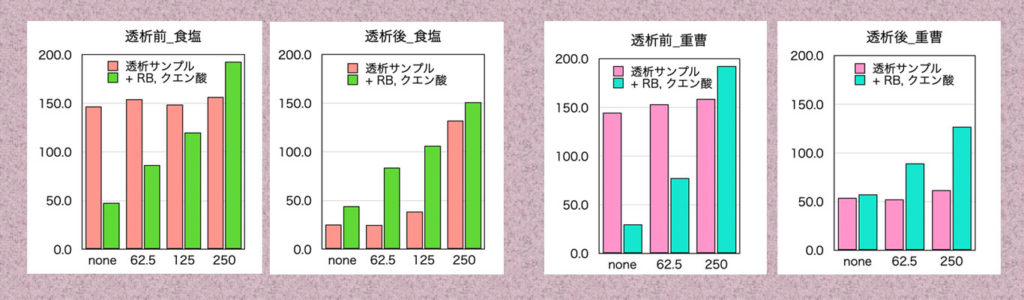
透析液は、1M 食塩水と0.1M 重曹溶液で行いました。下の図 (A) は、透析前のサンプルで1.5mL遠心チューブにローズベンガルとゼラチンを左から0, 62.5, 125, 250mg/mL加え1M の食塩水で透析しました。マイクロプレートの図は、上段が透析前のサンプルで下段がサンプルにローズベンガルとクエン酸を加えゼラチンの濃度を確認しました。透析後の (B) では、ゼラチンの濃度に比例してローズベンガルの色が残っています。同様に(C)は、0.1Mの重曹溶液で透析する前で (D) が透析後の結果です。マイクロプレートでの検討を行うため、水で透析してアルカリ性を中性に戻しています。
透析の結果から、ローズベンガルはゼラチンと吸着していることがわかりました。透析後のローズベンガルの色がサンプルにローズベンガルとクエン酸を加えゼラチンの濃度を確認した結果より色が薄いのは、透析によりローズベンガルの量が少なくなり平衡状態が変わったためと考えています。

マイクロプレートのデーターを数値化し、G-チャンネルの吸光度を縦軸に、ゼラチンの濃度を横軸にしたのが下の図です。
以上から、
ローズベンガルとクエン酸を最初に反応させ退色した状態でタンパク質の定量は出来ないようです。
ローズベンガルは、pH4付近で退色が始まります。
ローズベンガルとタンパク質の吸着を透析で確認できました。





ディスカッション
コメント一覧
まだ、コメントがありません